Freiwillige Feuerwehr Mönchhagen
gegr. 1924
Sie sind hier: → Startseite → Hintergrundwissen → Feuer
Hier geht es zur Internetseite des Feuerwehrvereins Mönchhagen: verein.feuerwehr-moenchhagen.de
Feuer – was ist das eigentlich?
Feuer bezeichnet die Flammenbildung bei der Verbrennung unter Abgabe von Wärme und Licht. Voraussetzungen für die Entstehung und Aufrechterhaltung eines Feuers sind die Anwesenheit eines Brennstoffs, eines Oxidationsmittels, wie etwa Sauerstoff aus der Luft, sowie eine Überschreitung der Zündtemperatur in der Flamme.
So steht es bei Wikipedia in der Einleitung. Wenn Sie das schon verstanden haben, brauchen Sie nicht weiterzulesen – für alle anderen fangen wir noch einmal ganz unten an, nämlich bei den Atomen.
Ein ganz kleines bisschen Atomphysik
Aus Atomen ist alle Materie um uns herum zusammengesetzt. Sie bestehen aus dem positiv geladenen Atomkern und einer bestimmten Anzahl negativer Elektronen – und zwar hat ein Atom genau so viele Elektronen, dass die positive Ladung im Atomkern ausgeglichen wird. Eine Atomsorte mit einer bestimmten Anzahl Elektronen bezeichnet man als chemisches Element. Wasserstoff ist beispielsweise das chemische Element mit der kleinsten Elektronenanzahl, er hat nämlich nur eins. Das nächste Element ist Helium mit 2 Elektronen, dann kommt Lithium mit 3 Elektronen, usw. Der Sauerstoff hat 8 Elektronen, Eisen hat 26 und Gold hat 79.
Nun schwirren die Elektronen nicht einfach irgendwie um den Atomkern, sondern sie nehmen bestimmte Plätze ein. Die Elektronenhülle ist unterteilt in einzelne Schalen, von denen jede eine bestimmte Zahl Elektronen aufnehmen kann. Diese Schalen werden von unten nach oben aufgefüllt, wenn man von Element zu Element geht (siehe Abbildung 1; man kann sich das vereinfacht so vorstellen, dass diese Schalen Bahnen sind, auf denen die Elektronen um den Kern herumfliegen – wer schon mal was von der Quantenmechanik gehört hat, weiß, dass es komplizierter ist, aber so genau brauchen wir das hier nicht).
Nun hat jedes Atom das Bestreben, einen Zustand zu erreichen, in dem seine äußerste Elektronenschale gefüllt ist.
Die erste (unterste) Schale fasst beispielsweise 2 Elektronen, die zweite fasst 8 Elektronen. Nehmen wir als Beispiel Sauerstoff. Der Sauerstoff hat 8 Elektronen, davon sitzen 2 in der untersten Schale, 6 in der zweiten Schale. Die zweite Schale ist also für den Sauerstoff die äußerste Schale. Diese ist aber nicht voll besetzt, es fehlen noch 2 Elektronen, die der Sauerstoff schrecklich gern dazubekommen möchte.
Statt eine Schale aufzufüllen, kann ein Element auch das Bestreben haben, Elektronen loszuwerden – wenn in der äußersten Schale beispielsweise nur 1 Elektron sitzt und das Atom dieses Elektron abgibt, wird die nächstinnere Schale zur äußeren Schale und die ist ja gefüllt. Der Sauerstoff muss sich also nur ein solches Element suchen, das gern Elektronen loswerden möchte – beispielsweise den Wasserstoff (ja gut, wenn der sein Elektron abgibt, hat er eigentlich überhaupt keine Elektronenschale mehr, er tut das aber trotzdem gern).
Wenn Sauerstoff noch zwei Elektronen braucht, Wasserstoff aber nur eins abgibt, braucht ein Sauerstoffatom also zwei Wasserstoffatome als Partner. Das ergibt dann eine der wichtigsten und bekanntesten chemischen Verbindungen überhaupt – Wasser!
Ein solches Gebilde aus mehreren Atomen heißt Molekül.
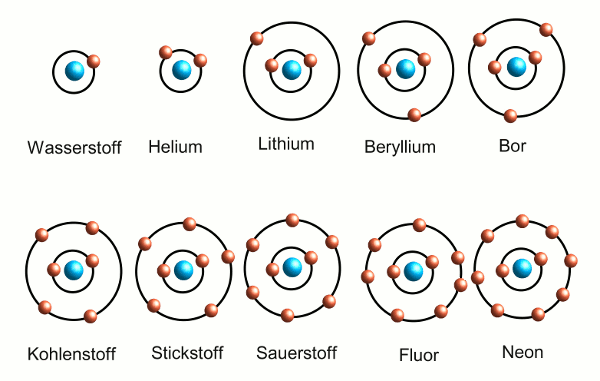
- Abbildung 1: Die ersten 10 chemischen Elemente; von der Nummer 1 (Wasserstoff) beginnend, werden die Elektronenschalen von unten nach oben aufgefüllt. Bei jedem weiteren Element kommt ein Elektron hinzu. Die Edelgase Helium und Neon haben jeweils vollständig gefüllt Elektronenschalen und reagieren nicht mit anderen Elementen.
Chemische Reaktionen
Sauerstoff übernimmt also zwei Elektronen von zwei Wasserstoffatomen. Anschaulich kann man sich das so vorstellen, dass die Elektronenschalen von Sauerstoff und Wasserstoff verschmelzen (Abbildung 2) und die beiden Elektronen sich nun auf Bahnen befinden, die um beide Atome liegen. Allerdings nimmt der Sauerstoff sich die Elektronen nicht ganz – ein bisschen bleiben sie auch bei den Wasserstoffatomen. Auf die Weise sorgen die Elektronen dafür, dass Sauerstoff- und Wasserstoffatom aneinandergebunden sind – man spricht von einer chemischen Bindung. Es sind also drei Atome aneinandergebunden, ein Molekül ist entstanden und zwar – wie viele wohl schon ahnen – ein Wassermolekül.
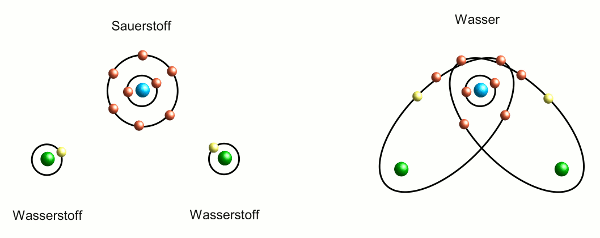
- Abbildung 2: Bildung eines Wassermoleküls aus einem Sauerstoff- und zwei Wasserstoffatomen. Aus den äußeren Elektronenbahnen von Sauerstoff und den Wasserstoffatomen bilden sich zwei neue Bahnen, die den Sauerstoff und je ein Wasserstoffatom umgeben. Zwei chemische Bindungen sind entstanden. Die Elektronen der Wasserstoffatome halten sich im Mittel mehr beim Sauerstoff auf.
Die Bildung von Wasser aus Wasserstoff und Sauerstoff ist eine chemische Reaktion. Auch der umgekehrte Vorgang, die Spaltung von Wasser in Wasserstoff und Sauerstoff ist eine chemische Reaktion. Ganz allgemein entstehen bei chemischen Reaktionen aus bestimmten Ausgangsstoffen (das können Atome, aber auch Moleküle sein) bestimmte Endprodukte (ebenfalls Atome oder Moleküle).
Während man Energie aufwenden muss, um Wasser in Wasserstoff und Sauerstoff zu zerlegen, wird bei der Bildung von Wasser aus den Ausgangsstoffen Energie frei – wie jeder weiß, der schon einmal von der Explosion der „Hindenburg“ gehört hat. Allerdings muss die Reaktion zwischen Wasserstoff und Sauerstoff nicht so heftig und zerstörerisch verlaufen, man kann sie auch kontrolliert ablaufen lassen, wie es in einer Brennstoffzelle geschieht.
Reaktionen, bei denen Energie in Form von Licht und Wärme abgegeben wird, nennt man exotherm, und es liegt auf der Hand, dass uns zum Thema „Feuer“ gerade diese interessieren.
Eine Verbrennung ist eine bestimmte Sorte chemischer Reaktionen – nämlich eine exotherme Reaktion, bei der die Atome eines brennbaren Materials mit Sauerstoff (in der Regel der Luftsauerstoff) reagieren und bei der es zur Flammenbildung kommt.
Für diejenigen mit Vorliebe für Fachbegriffe – eine Reaktion mit Sauerstoff ist eine Oxidation. Es gibt auch Oxidationen ohne Flammenbildung, z. B. das Rosten, bei dem Eisen oxidiert wird, oder auch das Verdauen von Nährstoffen im Körper. (Obwohl es beim Verdauen nicht zur Flammenbildung kommt, spricht man auch vom „Verbrennen“ von Kalorien.) Und es gibt auch Oxidationen mit anderen Oxidationsmitteln, beispielsweise Fluor statt Sauerstoff.
Dass eine Verbrennung Sauerstoff verbraucht, lässt sich in einem einfachen Experiment zeigen (Abbildung 3). Man zündet ein Teelicht an und stellt ein Glas darüber. Kurz darauf erlischt die Kerze, nur ein Rauchfaden ist noch kurze Zeit sichtbar. Der Grund dafür ist, dass die Flamme den Sauerstoff im Glas verbraucht hat. Wenn kein Sauerstoff mehr im Glas ist, fehlt der Verbrennung ein Ausgangsstoff, die Kerze erlischt. Das heiße Wachs verdampft noch eine Zeit lang, verbrennt aber nicht mehr (das ist der Rauchfaden.) Übrigens kann man in dem Experiment auch einen der Stoffe erkennen, die bei der Reaktion der Kerzenwachsdämpfe mit Sauerstoff (also der Verbrennung) entstehen, nämlich Wasser: Das Glas beschlägt.
Bei einem echten Brand geht von den unverbrannten Rauchgasen (dem, was hier der Rauchfaden ist), eine große Gefahr aus. Diese Rauchgase sammeln sich an und können sich dann sehr plötzlich entzünden, wenn die nötige Temperatur erreicht wird oder Sauerstoff zugeführt wird, siehe Backdraft & Co.

- Abbildung 3
In einem anderen einfachen Experiment kann man zeigen, dass auch das Rosten eine Reaktion mit Sauerstoff ist, also eine langsame „Verbrennung“ ohne Flammen. Man feuchtet etwas Stahlwolle an und stopft sie in ein Glas (es muss so viel sein, dass sie oben im Glas hängen bleibt). Dann stellt man das Glas umgedreht auf eine Untertasse (Abbildung 4; oben links) und gießt Wasser auf die Untertasse (oben rechts). Nach etwa drei Stunden kann man bereits sehen, dass Wasser in das Glas hineinläuft (unten links); nach einer Nacht steht das Wasser dann vollständig im Glas (unten rechts; wie lange es genau dauert, hängt natürlich von der Wassermenge ab). Wenn die Stahlwolle rostet, verbraucht sie Sauerstoff. Dieser fehlt dann der Luft im Glas. Dadurch sinkt der Luftdruck im Glas und der entstehende Unterdruck saugt das Wasser in das Glas. Im Blitzlicht kann am Ende des Experiments auch die Rostflecken auf der Stahlwolle gut erkennen.
Auch beim ersten Experiment fehlt der Luft der Sauerstoff, hier entstehen aber bei der Verbrennung andere Gase (Kohlendioxid und Wasserdampf), die dessen Platz einnehmen. Beim Rostvorgang entsteht Rost, der nimmt als Feststoff aber deutlich weniger Platz ein als ein Gas und spielt beim Druck im Glas keine Rolle. Zwar entsteht auch in dem Glas in Abb. 3 ein Unterdruck, der kommt aber zustande, weil die Luft nach dem Erlöschen der Kerze abkühlt und sich zusammenzieht.

- Abbildung 4
Zündtemperatur

- Abbildung 4: In einer Streichholzschachtel (Ecken mit Klebefilm abdichten!) kann man ohne Weiteres über einer offenen Flamme Wasser zum Kochen bringen: Wasser verdampft, wenn es eine Temperatur von 100 °C hat. Zum Verdampfen braucht es Energie und die holt es sich aus dem umgebenden Wasser. Beim Verdampfen nimmt es diese Energie mit, weshalb flüssiges Wasser nicht heißer als 100 °C werden kann – jedes Mehr an Energie, das zu einer Temperaturerhöhung führen könnte, wird mit dem verdampfenden Wasser abtransportiert. Damit wird aber auch die Streichholzschachtel nicht heißer als 100 °C und erreicht somit nicht die Temperatur, die Papier zum Entzünden braucht.
Trotzdem darf man das Experiment auf keinen Fall unbeaufsichtigt lassen – wenn zu viel Wasser verdampft ist, fängt die Streichholzschachtel nämlich doch an zu brennen! Deshalb steht die ganze Anordnung hier zur Sicherheit auch auf einem unbrennbaren Untergrund.
Holz ist ein brennbarer Stoff, wie jeder seit seinem ersten Lagerfeuer weiß. Trotzdem muss man normalerweise nicht befürchten, dass der Apfelbaum im Garten oder der Esstisch in der Küche von selbst in Flammen aufgehen, obwohl genügend Sauerstoff in der Luft um sie herum vorhanden ist. Das liegt daran, dass viele chemische Reaktionen durch eine „Energiebarriere“ daran gehindert werden, von selbst in Gang zu kommen.
Stellen Sie sich vor, ein Ball liegt auf der Spitze eines Kirchturms. Jetzt würden Sie erwarten, dass der Ball sofort herunterfällt, dieser Ball tut das aber nicht. Darüber wundern Sie sich zu Recht und sehen genauer hin. Dabei entdecken Sie, dass rund um den Ball ein Ring angebracht ist, in dem der Ball sicher liegt. Nun kommt eine Krähe angeflogen, neugierig, wie sie ist, stubst sie den Ball an. Der wird dabei leicht angehoben, sodass er über den Ring rutscht und nun natürlich in die Tiefe fällt. Durch das Anheben hat die Krähe dem Ball die Energie gegeben, die er brauchte, um die Barriere durch den Ring zu überwinden. Man nennt eine solche Energie „Aktivierungsenergie“, weil sie gewissermaßen den Vorgang, der durch die Barriere blockiert ist, aktiviert.
Genauso muss man sich das auch bei chemischen Reaktionen vorstellen – Holz (bzw. die Atome im Holz, u. a. der Kohlenstoff) möchte gern mit dem Sauerstoff reagieren, weil sich dadurch für alle Beteiligten eine günstigere Elektronenverteilung ergibt, aber es gibt eine Barriere (Energiebarriere), die die spontane Reaktion verhindert. Auch hier muss erst einmal eine Aktivierungsenergie zugeführt werden, um die Verbrennung in Gang zu bringen – man nehme ein Streichholz …
Eine Methode, die Aktivierungsenergie zuzuführen, ist also, Wärme zuzuführen, d. h., die Temperatur zu erhöhen. Ist die Verbrennung erst einmal in Gang gesetzt, hält sie selbst die Temperatur hoch genug und liefert sich selbst so die nötige Aktivierungsenergie für das Fortdauern der Verbrennung.
Das bedeutet aber auch, dass ein Material sich selbst entzünden kann, wenn seine Temperatur so hoch ist, dass es sich die Aktivierungsenergie sozusagen aus sich selbst holen kann. Die Temperatur, bei der sich ein Stoff selbst entzündet, nennt man Zündtemperatur. Für Papier liegt sie um 200 °C; für Holz um 300 °C, für Diesel zwischen 250 und 350 °C.
Wenn eine Erhöhung der Temperatur die Aktivierungsenergie liefert, liegt der Umkehrschluss nahe – dass eine Erniedrigung der Temperatur dazu führt, dass die Aktivierungsenergie nicht mehr ausreichend zur Verfügung steht und die Verbrennung stoppt oder gar nicht erst in Gang kommt. Deshalb ist es durchaus möglich, Wasser in einer Streichholzschachtel zu kochen (Abbildung 4).
Und ja, Sie ahnen es – deshalb kann man mit Wasser Feuer löschen oder sein Übergreifen auf Nachbargebäude verhindern.
Feuer – Licht und Wärme
Jetzt wissen wir also, was bei einer Verbrennung passiert. Aber das eigentliche Feuer sind die Flammen, die sich bei einer Verbrennung bilden. Flammen sind heiß und leuchten; sie sind also ein Ausdruck der Energie, die bei einer Verbrennung frei wird, in Form von Wärme und Licht. Um zu verstehen, was genau Flammen sind, müssen wir uns wieder den Atomen und Molekülen zuwenden.
Die Energie, die bei einer exothermen Reaktion frei wird, sitzt zunächst in den Atomen und Molekülen, die bei dieser Reaktion entstanden sind. Das äußert sich zum Beispiel dadurch, dass die Teilchen nach der Reaktion nicht still daliegen, sondern sich bewegen – sie haben Bewegungsenergie. Die Bewegung von Atomen können wir nicht sehen, aber wahrnehmen können wir sie auf andere Weise: Bewegung von Atomen ist nichts anderes als Wärme. Je schneller sich die Atome in einem Material bewegen, desto wärmer ist es, desto höher ist seine Temperatur. Erhitzt man beispielsweise ein Stück Metall, kann man ihm zunächst nicht ansehen, dass seine Temperatur zunimmt. Irgendwann fängt es an, rot zu glühen. Die Farbe des Glühens wird mit zunehmender Temperatur heller, über gelblich bis schließlich zu weiß. Was passiert hier?

- Glut im Kaminofen
Auch das hängt mit der Bewegung der Atome zusammen – wenn die Atome sich bewegen, bewegen sich auch deren Bausteine, die Elektronen und Atomkerne. Die sind beide elektrisch geladen. Wenn eine elektrische Ladung sich beschleunigt bewegt, gibt sie elektromagnetische Wellen ab. (Dass die Bewegung eine beschleunigte Bewegung sein muss, ist wichtig.)
„Beschleungigung“ bedeutet, dass sich die Bewegung in Betrag oder Richtung der Geschwindigkeit ändert. Ein Gegenstand, der gleich schnell bleibt, aber seine Bewegungsrichtung ändert, wird daher beschleunigt. Und natürlich ist auch ein Abbremsen im physikalischen Sinne eine Beschleunigung.
Wenn die Atome in Molekülen zum Beispiel schwingen oder wenn Atome in Gasen herumfliegen und dabei immer wieder gegen andere Atome stoßen und abgelenkt werden oder ihre Geschwindigkeit ändern, treten jedes Mal Beschleunigungen auf. Deshalb erzeugt die Wärmebewegung der Atome und Moleküle also elektromagnetische Wellen, weshalb der Körper, zu dem diese Atome gehören, elektromagnetische Strahlung abgibt, die sogenannte Wärmestrahlung.
Das tut jeder Körper, der eine Temperatur hat, die über dem absoluten Temperaturnullpunkt liegt, der also wärmer ist als −273 °C. In unserer gewöhnlichen Umgebuns also eigentlich alle und alles. Solange ein Körper nicht glüht, liegt diese Strahlung im Wesentlichen im Infraroten, also im nicht sichtbaren Bereich (daher kommt es, dass im Alltag der Begriff „Wärmestrahlung“ meist mit Infrarotstrahlung gleichgesetzt wird; der Physiker versteht darunter aber jede Strahlung, die ein Körper aufgrund seiner Temperatur abgibt). Wenn der Körper so heiß wird, dass er anfängt zu glühen, sendet er auch elektromagnetische Strahlung aus, die im Bereich des sichtbaren Lichtes liegt. Je heißer ein Körper ist, desto kürzere Wellenlängen sendet er aus und sichtbares Licht hat kürzere Wellenlängen als Infrarotstrahlung
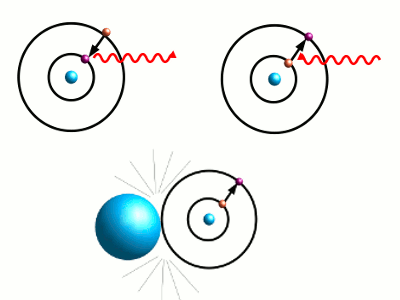
- Abbildung 5: Springt ein Elektron von einer höheren Schale auf eine niedrigere, gibt es Energie in Form von elektromagnetischer Strahlung ab (oben rechts). Umgekehrt kann einfallende elektromagnetische Strahlung einem Elektron die nötige Energie zuführen, damit es in eine höhere Schale springen kann (oben links). Auch durch Stöße mit anderen Atomen kann es diese Energie erhalten (unten).
Spätestens jetzt müssen wir neben den Bewegungen der Atome auch die Bewegungen der Elektronen innerhalb der Atome berücksichtigen. Oben wurde schon erwähnt, dass die Elektronen eines Atoms in bestimmten Schalen sitzen. Ist in einer Schale ein Platz frei, kann ein Elektron von einer anderen Schale auf diesen Platz springen.
Springt es auf eine höhere Schale, muss es dazu Energie aufnehmen. Beispielsweise kann ein Stoß eines anderen Atoms dafür sorgen, dass ein Elektron des gestoßenen Atoms in eine höhere Schale springt; oder auch eine einfallende elektromagnetische Welle kann die nötige Energie liefern.
Springt das Elektron in eine niedrigere Schale, gibt es Energie ab, und zwar in Form von elektromagnetischer Strahlung (Abbildung 5). (Auch dieses Hin-und-her-Springen kann man sich als Bewegung einer elektrischen Ladung denken, bei der dann ebenfalls elektromagnetische Strahlung abgegeben wird.) Welche Wellenlänge die abgegebene Strahlung hat, hängt davon ab, wie groß der Abstand zwischen den Bahnen ist; es kann infrarotes, aber eben auch sichtbares Licht abgegeben werden.
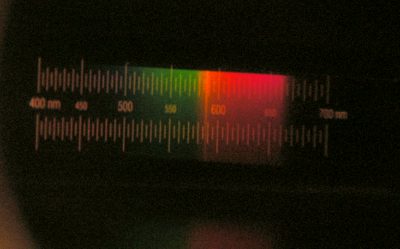
- Abbildung 6: Das Licht dieses Holzfeuers enthält kein Blau, sondern überwiegend Rot und Grün und eine schmale gelbe Linie. Diese Linie liegt bei knapp 590 nm; es könnte sich also um die bekannte gelbe Natriumlinie handeln. Diese intensive gelbe Linie (eigentlich sind es zwei sehr dicht beianderliegende Linien) ist für die Gelbfärbung des Lichtes von Natriumdampflampen verantwortlich. Und das Vorhandensein von Natriumsalzen irgendwo in oder auf dem Kaminholz ist nicht unmöglich, Natrium kommt in organischem Gewebe vor.
Die Abstände der Bahnen sind sehr charakteristisch für jedes chemische Element. Das Licht eines gewöhnlichen Feuers ist ein Gemisch aus allen beteiligten Wellenlängen. Wenn man nun das Licht eines Feuers (oder von was auch immer) durch ein sogenanntes Spektroskop betrachtet (das ist ein Gerät, das aufschlüsseln kann, welche Wellenlängen im Licht beteiligt sind), kann man herausbekommen, welche Atome und Moleküle im Feuer vorkommen. Die Abbildung 6 zeigt das Spektrum eines Holzfeuers, aufgenommen durch ein sehr einfaches Spektroskop.
Zusammenfassung
Feuer entsteht also, wenn die Atome eines Materials mit dem (Luft)Sauerstoff chemisch reagieren. Dazu ist eine Aktivierungsenergie erforderlich, die durch ein Streichholz, umfallende Kerzen usw. zugeführt werden kann. Bei der Verbrennung wird Energie frei, die als Wärmestrahlung (entsteht durch die Wärmebewegung der Teilchen) und sichtbares Licht (wird in der Elektronenhülle erzeugt) abgegeben wird.
Copyright© 2010, Feuerwehr Mönchhagen

